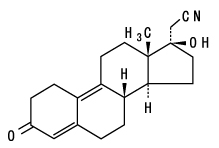


禁忌(次の患者には投与しないこと) 1. |
| 投与量 | Cmax (ng/mL) | tmax (hr) | t1/2α
(hr) | t1/2β
(hr) | AUC0-∞
(ng・hr/mL) |
| 0.5mg | 17.5±2.2 | 0.9±0.2 | 0.749±0.201 | 7.06±1.00 | 154.9±34.2 |
| 1mg | 34.7±3.1 | 1.3±0.6 | 0.772±0.364 | 6.65±1.49 | 320.4±56.7 |
| 2mg | 76.1±14.6 | 1.2±0.4 | 0.580±0.209 | 7.66±1.22 | 695.1±114.2 |
| 投与回数 | Cmax (ng/mL) | tmax (hr) | t1/2β
(hr) | AUC注)
(ng・hr/mL) |
| 1回目 | 28.0±3.2 | 2.1±0.9 | 8.56±1.91 | 313.5±29.2 |
| 11回目 | 42.9±2.7 | 2.7±0.5 | 12.44±3.17 | 341.2±31.5 |
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ | |
| AUC0-48
(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
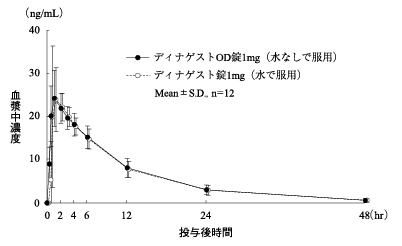
| ディナゲストOD錠1mg (水なしで服用) | 282.80±66.37 | 25.81±4.87 | 1.25±0.94 | 7.98±1.85 |
| ディナゲスト錠1mg (水で服用) | 275.16±65.27 | 28.95±7.69 | 1.25±0.89 | 7.92±1.92 |
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ | |
| AUC0-48
(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
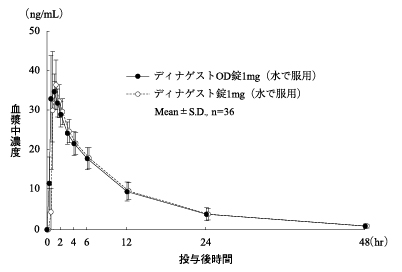
| ディナゲストOD錠1mg (水で服用) | 351.35±77.52 | 37.68±6.38 | 0.79±0.30 | 8.35±2.11 |
| ディナゲスト錠1mg (水で服用) | 353.08±71.80 | 39.10±6.79 | 0.90±0.41 | 8.29±1.89 |