ダレンカプセル 1mg/ダレンカプセル 2mg
作成又は改訂年月
- **2013年5月改訂 (第7版:第十六改正日本薬局方収載に基づく改訂)
- *2010年10月改訂
日本標準商品分類番号
- 87449
日本標準商品分類番号等
- 再審査結果公表年月(最新)
- 2003年3月
- 効能又は効果追加承認年月(最新)
- 1996年9月
薬効分類名
- アレルギー性疾患治療剤
承認等
- 販売名
-
ダレンカプセル 1mg
販売名コード
- 4490013M1020
承認・許可番号
- 承認番号
- 20500AMZ00147000
- 欧文商標名
- DAREN Capsules 1mg
薬価基準収載年月
- 1993年5月
販売開始年月
- 1993年8月
貯法・使用期限等
- **貯法
-
気密容器、室温保存
- *使用期間
- 3年
- 使用期限
- 包装に表示の使用期限内に使用すること。
基準名
- 日本薬局方
- エメダスチンフマル酸塩徐放カプセル
組成
- **有効成分
-
日本薬局方 エメダスチンフマル酸塩 1.0mg
- 添加物
- トウモロコシデンプン、白糖、ヒドロキシプロピルセルロース、その他3成分
カプセル本体: ラウリル硫酸ナトリウム
性状
- 製剤の性状
- 硬カプセル (キャップ白、ボディ白)
- 識別コード
- NR1
ORGANON
- 外形等
-

- 重さ (mg)
- 195
- 号数
- 4号
- 販売名
-
ダレンカプセル 2mg
販売名コード
- 4490013M2026
承認・許可番号
- 承認番号
- 20500AMZ00148000
- 欧文商標名
- DAREN Capsules 2mg
薬価基準収載年月
- 1993年5月
販売開始年月
- 1993年8月
貯法・使用期限等
- **貯法
-
気密容器、室温保存
- *使用期間
- 3年
- 使用期限
- 包装に表示の使用期限内に使用すること。
基準名
- 日本薬局方
- エメダスチンフマル酸塩徐放カプセル
組成
- **有効成分
-
日本薬局方 エメダスチンフマル酸塩 2.0mg
- 添加物
- トウモロコシデンプン、白糖、ヒドロキシプロピルセルロース、その他3成分
カプセル本体: ラウリル硫酸ナトリウム
性状
- 製剤の性状
- 硬カプセル (キャップ白、ボディ白)
- 識別コード
- NR2
ORGANON
- 外形等
-

- 重さ (mg)
- 195
- 号数
- 4号
効能又は効果
効能又は効果/用法及び用量
アレルギー性鼻炎、
蕁麻疹、湿疹・皮膚炎、皮膚そう痒症、痒疹
- 通常、成人にはエメダスチンフマル酸塩として1回1〜2mgを1日2回、朝食後及び就寝前に経口投与する。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
- 肝障害又はその既往歴のある患者[肝機能異常があらわれるおそれがある。]
重要な基本的注意
- 1.
- 眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう十分注意すること。更に、日常生活に支障がみられる場合があるので、本剤投与に際してはこのことを患者に十分説明しておくこと。
- 2.
- 4mg/日投与は、2mg/日投与に比して高度の眠気を惹起する可能性が高いので留意すること。
- 3.
- 長期ステロイド療法を受けている患者で、本剤投与によりステロイドの減量を図る場合には十分な管理下で徐々に行うこと。
- 4.
- 本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
相互作用
併用注意
(併用に注意すること)
- 薬剤名等
向精神薬
鎮静剤
催眠剤等
抗ヒスタミン剤
- 臨床症状・措置方法
- 相互に作用を増強するおそれがある。
- 機序・危険因子
- 本剤の中枢神経抑制作用により、作用が増強されると考えられる。
- 薬剤名等
アルコール
- 臨床症状・措置方法
- 本剤の中枢神経系での副作用(主に眠気)を増強するおそれがある。
- 機序・危険因子
- 本剤の中枢神経抑制作用により、作用が増強されると考えられる。
副作用
- 承認時及び市販後の使用成績調査の症例14,168例中1,040例(7.34%)に副作用がみられた。主な副作用は眠気(6.30%)、倦怠・脱力感(0.61%)、口渇(0.23%)、腹痛(0.14%)、ふらつき(0.13%)、頭痛・頭重感(0.11%)、頭がボーッとする(0.10%)等であった。臨床検査値の変動はALT(GPT)上昇(0.21%)、AST(GOT)上昇(0.16%)、LDH上昇(0.13%)、γ-GTP上昇(0.10%)等であった1〜5)。次のような副作用症状が認められた場合には、必要に応じ、減量、投与中止等の適切な処置を行うこと。なお、男女別にみると女性の副作用症状発現率が高かった。〔再審査終了時〕
- 精神神経系
- (頻度不明)
- 舌のしびれ、一過性健忘
- 精神神経系
- (5〜10%未満)
- 眠気
- 精神神経系
- (0.1〜5%未満)
- 倦怠・脱力感、頭痛・頭重感、頭がボーッとする、ふらつき
- 精神神経系
- (0.1%未満)
- しびれ感、耳鳴、こわばり、皮膚感覚異常
- 消化器
- (0.1〜5%未満)
- 口渇、腹痛
- 消化器
- (0.1%未満)
- 悪心・嘔吐、食欲不振、胃部不快感、胃もたれ感、腹部膨満感、下痢、便秘
- 循環器
- (頻度不明)
- 動悸、血圧上昇
- 過敏症注1)
- (0.1%未満)
- 発疹、そう痒
- 血液
- (0.1%未満)
- 白血球減少、血小板減少
- 肝臓注2)
- (頻度不明)
- 黄疸
- 肝臓注2)
- (0.1〜5%未満)
- AST(GOT)上昇、ALT(GPT)上昇、LDH上昇、γ-GTP上昇
- 肝臓注2)
- (0.1%未満)
- 総ビリルビン上昇、Al-P上昇、肝機能異常
- 腎臓
- (0.1%未満)
- 尿蛋白、尿潜血、血尿、頻尿、尿量減少
- 眼
- (0.1%未満)
- 眼のしょぼしょぼ感、眼痛
- その他
- (頻度不明)
- 息苦しさ、月経異常、胸痛、ほてり
- その他
- (0.1%未満)
- 浮腫、苦味、鼻乾燥
- 注1) 投与を中止すること。
- 注2) 観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
高齢者への投与
- 副作用の発現に注意し、1回1mgから投与するなどの配慮をすること[一般に高齢者では生理機能が低下している。]。
妊婦、産婦、授乳婦等への投与
- 1.
- 妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること[妊娠中の投与に関する安全性は確立していない。]。
- 2.
- 授乳中の婦人には投与しないことが望ましいが、やむを得ず投与する場合には授乳を避けさせること[動物実験(ラット)で乳汁中へ移行することが報告されている。]。
小児等への投与
- 低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない[使用経験が少ない。]。
臨床検査結果に及ぼす影響
- 本剤は、アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する前は本剤を投与しないこと。
適用上の注意
- 1.
服用時:
- 本剤は徐放剤のため、かまずにそのまま服用すること。
- 2.
薬剤交付時:
- PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。]。
薬物動態
- 1.
吸収6)
- 健常成人5名にダレンカプセルをエメダスチンフマル酸塩として2mg食後単回経口投与した場合、下記の薬物速度論的パラメータが得られた。
(「表1. 薬物速度論的パラメータ」参照のこと)
1回2mgを1日2回14日間反復経口投与した場合、血漿中濃度は投与5回目で定常状態に達し、0.96〜1.87ng/mLであった。
- 2.
代謝7)
- 本剤の主代謝経路はベンズイミダゾール環の水酸化とそれに引き続く抱合化であった。
- 3.
排泄6,7)
- 健常成人にダレンカプセルをエメダスチンフマル酸塩として2mg食後単回経口投与した場合、投与後24時間までに尿中へ排泄された未変化体及び代謝物の合計は投与量の44.1%であった。未変化体は投与量の3.6%を示した。
- (参考) 動物での吸収、分布、代謝、排泄8〜13)
- ラットに経口投与された14C-エメダスチンフマル酸塩は小腸から速やかにかつほぼ完全に吸収され、特に肝臓及び腎臓に高い分布を認めたが、中枢系への移行は低かった。エメダスチンは主に肝臓において代謝された。尿中への排泄率はラットで約30%、モルモットで約40%、イヌで約70%であり、ラットにおいて胆汁中排泄及び腸肝循環が認められた。また、妊娠ラットにおいて胎仔中への移行が認められ、授乳期ラットにおいて乳汁中への移行が認められた。
表1. 吸収の薬物速度論的パラメータ
| Cmax | Tmax | AUC0-∞ | T1/2 |
| 1.26ng/mL | 3.1時間 | 15.7ng・h/mL | 7.0時間 |
臨床成績
- 二重盲検比較試験を含む958例についての成績は以下のとおりである。また、アレルギー性鼻炎、蕁麻疹を対象とした二重盲検比較試験において本剤の有用性が認められた。
| 対象疾患名 | 改善率(%)
中等度改善以上 | 改善率(%)
軽度改善以上 |
| アレルギー性鼻炎1,2) | 43.5(111例/255例) | 83.1(212例/255例) |
| 蕁麻疹(主に慢性)3) | 69.6(272例/391例) | 85.4(334例/391例) |
| 湿疹・皮膚炎4) | 71.0(115例/162例) | 88.3(143例/162例) |
| 皮膚そう痒症4) | 72.5 (66例/91例) | 91.2 (83例/91例) |
| 痒疹4) | 74.6 (44例/59例) | 93.2 (55例/59例) |
薬効薬理
- 1.
抗アレルギー作用
- モルモットでのアナフィラキシーショック及びモルモットやラットでのpassive cutaneous anaphylaxisを経口投与で抑制した14,15)。ラットでの実験的アレルギー性鼻炎を経口投与で抑制した16)。
- 2.
抗ヒスタミン作用17)
- ヒスタミンによるモルモット摘出回腸収縮反応を抑制した(in vitro)。モルモットでのヒスタミン致死及び血管透過性亢進に対して抑制を示した(in vivo)。
- 3.
抗原抗体反応によるケミカルメディエーター遊離抑制作用
- 抗原抗体反応によるラット腹腔肥満細胞からのヒスタミン遊離反応14)並びにヒト末梢白血球及び肺組織からのヒスタミン及びロイコトリエンC4遊離を濃度依存的に抑制した(in vitro)18)。モルモットpassive peritoneal anaphylaxisによるヒスタミン遊離に対して抑制作用を示した(in vivo)19)。
- 4.
サブスタンスPによるヒスタミン遊離に対する抑制作用19)
- サブスタンスPによるラット腹腔肥満細胞からのヒスタミン遊離を低濃度から抑制した(in vitro)。このヒスタミン遊離抑制作用は、細胞内Ca貯蔵部位からのCa2+放出抑制作用及び細胞内へのCa2+の流入抑制作用による。
- 5.
好酸球遊走阻止及び浸潤抑制作用
- PAFによるモルモット好酸球の遊走を10-9M以上で濃度依存的に抑制した(in vitro)20)。
PAF、ロイコトリエンB4によるヒト好酸球の遊走を10-8M以上で濃度依存的に抑制した(in vitro)21)。
モルモット鼻アレルギーモデルにおいて、鼻粘膜への好酸球の浸潤を経口投与で抑制した22)。
有効成分に関する理化学的知見
- **一般名:
- エメダスチンフマル酸塩 (Emedastine Fumarate)
- **化学名:
- 1-(2-Ethoxyethyl)-2-(4-methyl-1,4-diazepan-1-yl)-1H -benzoimidazole difumarate
- 分子式:
- C17H26N4O・2C4H4O4
- **分子量:
-
534.56
- 構造式:
-
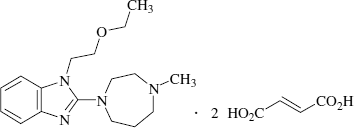
- **性状:
- 白色〜微黄色の結晶性の粉末である。水に溶けやすく、メタノールにやや溶けやすく、エタノール(99.5)にやや溶けにくく、酢酸(100)に溶けにくい。
結晶多形が認められる。
- **融点:
-
149〜152℃
包装
-
ダレンカプセル1mg:
100カプセル (PTP10カプセル×10)
500カプセル (PTP10カプセル×50)
1,000カプセル (PTP10カプセル×100)
-
ダレンカプセル2mg:
100カプセル (PTP10カプセル×10)
500カプセル (PTP10カプセル×50)
1,000カプセル (PTP10カプセル×100)
主要文献及び文献請求先
主要文献
- 1)
- 奥田 稔ほか:耳鼻咽喉科展望 33, 113 (1990)
- 2)
- 奥田 稔ほか:耳鼻咽喉科展望 33, 543 (1990)
- 3)
- 石橋康正ほか:臨床医薬 5, 2291 (1989)
- 4)
- 石橋康正ほか:臨床医薬 10, 1919 (1994)
- 5)
- 中島重徳ほか:臨床医薬 5, 2561 (1989)
- 6)
- 中島重徳ほか:基礎と臨床 23, 5431 (1989)
- 7)
- 浜田 司ほか:薬物動態 5, 871 (1990)
- 8)
- 酒井孝範ほか:薬物動態 2, 123 (1987)
- 9)
- 酒井孝範ほか:薬物動態 2, 133 (1987)
- 10)
- 酒井孝範ほか:薬物動態 2, 147 (1987)
- 11)
- 粟田則男ほか:薬学雑誌 109, 318 (1989)
- 12)
- 和田幸雄ほか:薬物動態 4, 459 (1989)
- 13)
- 和田幸雄ほか:薬物動態 4, 471 (1989)
- 14)
- Fukuda, T., et al.:Arzneimittelforschung 34, 805 (1984)
- 15)
- 斉藤忠之ほか:日本薬理学雑誌 89, 55 (1987)
- 16)
- 斉藤忠之ほか:基礎と臨床 23, 3145 (1989)
- 17)
- Fukuda, T., et al.:Arzneimittelforschung 34, 801 (1984)
- 18)
- Nishimura, N., et al.:Immunopharmacol. Immunotoxicol. 9, 511 (1987)
- 19)
- Saito, T., et al.:Jpn. J. Pharmacol. 62, 137 (1993)
- 20)
- 松田直美ほか:薬理と治療 21, 1475 (1993)
- 21)
- 斉藤忠之ほか:西日本皮膚科 55, 1081 (1993)
- 22)
- 成田慎一郎ほか:耳鼻咽喉科臨床 89, 645 (1996)
文献請求先・製品情報お問い合わせ先
- *MSD株式会社 MSDカスタマーサポートセンター
- 東京都千代田区九段北1-13-12
- 医療関係者の方: フリーダイヤル0120-024-961
製造販売業者等の氏名又は名称及び住所
- *製造販売元
-
MSD株式会社
- 東京都千代田区九段北1-13-12



