

禁忌(次の患者には投与しないこと)
|
原則禁忌(次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること)
|
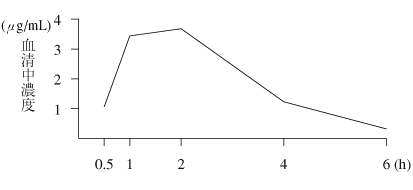
| 測定時間 | 30分 | 1時間 | 2時間 | 4時間 | 6時間 |
| 血清中濃度 (μg/mL) | 1.06 | 3.44 | 3.68 | 1.23 | 0.32 |
| 測定症例数 | 46 | 56 | 56 | 54 | 54 |
| Tmax(hr) | Cmax(μg/mL) | t1/2(hr) | AUC(μg・hr/mL) |
| 1.67±0.52 | 10.05±1.62 | 1.0±0.2 | 29.04±7.15 |
| Tmax(hr) | Cmax(μg/mL) | t1/2(hr) | AUC0〜∞(μg・hr/mL) |
| 4.2±1.1 | 5.6878±1.7574 | 1.15±0.14※ | 27.069±10.002※ |
| Tmax(hr) | Cmax(μg/mL) | t1/2(hr) | AUC0〜12(μg・hr/mL) |
| 1.63±0.37 | 9.86±2.79 | 1.09±0.19※ | 25.82±5.41※ |
| 疾患名 | 有効率: 有効以上(%) | 有効率: やや有効以上(%) |
| 皮膚感染症:表在性皮膚感染症(毛嚢炎、膿痂疹) | 23/35(65.7) | 34/35(97.1) |
| 皮膚感染症:深在性皮膚感染症(せつ、ひょう疽、蜂窩織炎等) | 52/68(76.5) | 59/68(86.8) |
| 皮膚感染症:リンパ管・リンパ節炎 | 8/9(88.9) | 8/9(88.9) |
| 皮膚感染症:慢性膿皮症(感染粉瘤、膿瘍、膿皮症、ざ瘡) | 19/29(65.5) | 25/29(86.2) |
| 外科・整形外科領域感染症:外傷・熱傷及び手術創等の二次感染 | 11/20(55.0) | 15/20(75.0) |
| 外科・整形外科領域感染症:びらん・潰瘍の二次感染 | 3/7(42.9) | 5/7(71.4) |
| 外科・整形外科領域感染症:乳腺炎 | 7/10(70.0) | 8/10(80.0) |
| 外科・整形外科領域感染症:骨髄炎 | 6/9(66.7) | 6/9(66.7) |
| 呼吸器感染症:咽頭炎 | 9/10(90.0) | 9/10(90.0) |
| 呼吸器感染症:扁桃炎 | 80/95(84.2) | 82/95(86.3) |
| 呼吸器感染症:気管支炎 | 34/44(77.3) | 38/44(86.4) |
| 呼吸器感染症:肺炎 | 58/68(85.3) | 61/68(89.7) |
| 尿路感染症:膀胱炎 | 215/270(79.6) | 217/270(80.4) |
| 尿路感染症:腎盂腎炎(腎盂腎炎、腎盂炎) | 41/63(65.1) | 43/63(68.3) |
| 尿路感染症:前立腺炎 | 16/19(84.2) | 16/19(84.2) |
| 尿路感染症:精巣上体炎(副睾丸炎) | 2/2(-) | 2/2(-) |
| 淋菌感染症 | 59/68(86.8) | 59/68(86.8) |
| 婦人科感染症:子宮内感染 | 27/35(77.1) | 27/35(77.1) |
| 婦人科感染症:子宮付属器炎 | 31/38(81.6) | 32/38(84.2) |
| 婦人科感染症:子宮旁結合織炎 | 2/4(-) | 2/4(-) |
| 眼科感染症:涙嚢炎 | 2/4(-) | 4/4(-) |
| 眼科感染症:麦粒腫 | 20/32(62.5) | 26/32(81.3) |
| 耳鼻科感染症:中耳炎 | 44/54(81.5) | 45/54(83.3) |
| 歯科・口腔外科領域感染症:歯周組織炎(歯槽骨炎、歯根膿瘍) | 11/14(78.6) | 11/14(78.6) |
| 歯科・口腔外科領域感染症:歯冠周囲炎(智歯周囲炎) | 9/14(64.3) | 12/14(85.7) |
| 歯科・口腔外科領域感染症:顎炎(顎骨周囲炎、急性顎炎) | 12/18(66.7) | 16/18(88.9) |
| 猩紅熱 | 42/43(97.7) | 43/43(100) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率 |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) ランソプラゾール 30mg | 2回/日 | 87.5% (84/96例) |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) ランソプラゾール 30mg | 2回/日 | 89.2% (83/93例) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率 |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) ランソプラゾール 30mg | 2回/日 | 91.1% (82/90例) |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) ランソプラゾール 30mg | 2回/日 | 83.7% (82/98例) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率:胃潰瘍 | 除菌率:十二指腸潰瘍 | 除菌率:計 |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) オメプラゾール 20mg | 2回/日 | 75.9% (44/58) | 81.8% (45/55) | 78.8% (89/113) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率:胃潰瘍 | 除菌率:十二指腸潰瘍 | 除菌率:計 |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) ラベプラゾールナトリウム 10mg | 2回/日 | 87.7% (57/65) | 83.3% (45/54) | 85.7% (102/119) |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) ラベプラゾールナトリウム 10mg | 2回/日 | 89.7% (61/68) | 87.8% (36/41) | 89.0% (97/109) |
 0120-189-371
0120-189-371