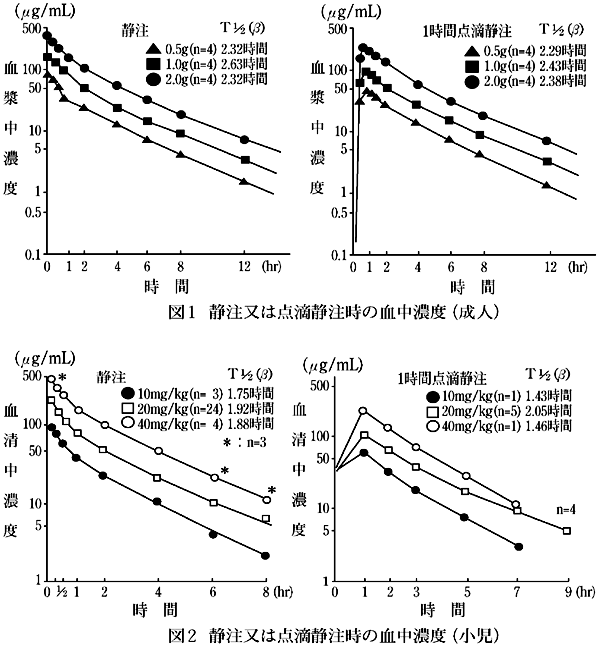
- (1) 喀痰中移行4〜8)
- 慢性気管支炎等の患者に本剤1g及び2gを1時間点滴静注したときの喀痰中濃度はそれぞれ最高値1.23±1.51μg/mL及び2.68±2.05μg/mLであった。
- (2) 胆嚢組織・胆汁中移行9)
- 胆嚢摘出術患者に本剤1gを術前点滴静注し、2〜5時間後に摘出した胆嚢組織及び胆汁中濃度はそれぞれ72.1±41.0μg/g及び1530±1300μg/mLであった。
- (3) 腹腔内滲出液中移行10)
- 胆嚢摘出術患者に本剤1gを1日2回3日間静脈内投与したときの腹腔内滲出液中濃度は術後1、2、3日目とも投与後3時間でそれぞれ最高値28.0±8.3μg/mL、39.3±11.4μg/mL、40.9±10.2μg/mLであった。
- (4) 耳漏中移行11)
- 患者に本剤1gを静脈内注射したときの耳漏中濃度(平均)は1時間後で2.45μg/gであり、2時間後で最高値14.07μg/gであった。
- (5) 婦人性器組織内移行12)
- 患者に本剤1gを静脈内注射したときの婦人性器組織(卵管、卵巣、子宮内膜、子宮筋層、子宮頸部及び子宮腟部)中濃度は静注終了0.35〜1.86時間後で最高値19.15〜36.06μg/gであった。
- (6) 髄液中移行3)
- 髄膜炎の小児患者に本剤50mg/kgを1日ないし8日間静脈内注射したときの髄液中濃度は静注終了0.25〜6.5時間後で0.76〜9.48μg/mLであった。