厚さ 約 5.2mm

警告 |
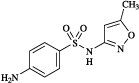
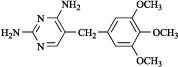
禁忌(次の患者には投与しないこと)
|
原則禁忌(次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること)
|

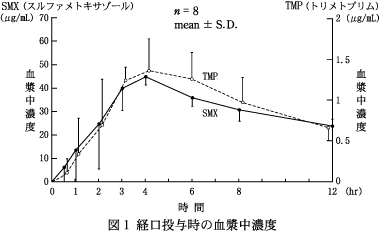
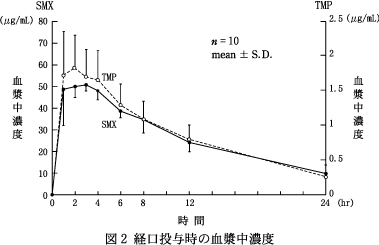
| 投与量 (錠) | n | Cmax (μg/mL) | Tmax (hr) | AUC0-12
(μg・hr/mL) | T1/2
(hr) |
|
| 2 | 8 | SMX | 46.8±3.9 | 3.4±0.9 | 352.83±53.09 | 7.8±0.8 |
| 2 | 8 | TMP | 1.46±0.31 | 3.3±0.7 | 11.10±2.30 | 6.8±1.2 |
| 投与量 (g) | n | Cmax (μg/mL) | Tmax (hr) | AUC0-24
(μg・hr/mL) | T1/2
(hr) |
|
| 2 | 10 | SMX | 58.0±6.5 | 1.7±0.7 | 675.49±100.73 | 9.4±1.6 |
| 2 | 10 | TMP | 2.06±0.34 | 2.0±1.2 | 21.74±4.06 | 8.2±3.7 |